Денатурация— разрушение пространственной структуры белка.



Она происходит при нагревании белков, под действием радиоактивного излучения, некоторых химических веществ (кислот, щелочей, солей тяжёлых металлов). При денатурации белки изменяют свои свойства и теряют биологическую активность, несмотря на то, что их первичная структура сохраняется.
Примером денатурации служит изменение яичного белка при нагревании.
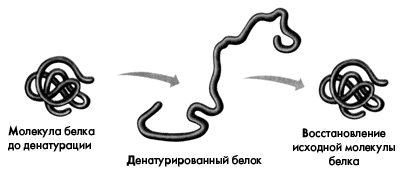
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурациябелка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рис. 4).
Рис. 2. Денатурация и ренатурация белковой молекулы.
Деструкция– необратимый процесс нарушения первичной структуры
Разложение при нагревании
При сильном нагревании белки горят . При этом образуются вещества со своеобразным запахом жженых перьев. По запаху можно легко отличить шерстяные или шёлковые волокна от синтетических.
Цветные реакции
Присутствие белка в растворе можно обнаружить с помощью качественных реакций, в результате которых образуются окрашенные продукты.
Если к раствору белка добавить раствор щёлочи и несколько капель раствора соли меди(II), то появляется красно-фиолетовое окрашивание. Эта реакция называется биуретовой.
Другая цветная реакция на белки ксантопротеиновая. Для её проведения к раствору белка при нагревании надо добавить концентрированную азотную кислоту . Образуется желтый осадок. Если после охлаждения в пробирку прилить раствор щёлочи или концентрированный раствор аммиака, то появится оранжевое окрашивание.
Таким образом,все белки – биополимеры, мономерами которых являются остатки аминокислот, соединенных пептидной связью. Различают четыре уровня пространственной организации белков: первичную, вторичную, третичную и четвертичную. Белки способны к денатурации и ренатурации (изменению и восстановлению своих высших структур), деструкции (необратимому нарушению первичной структуры). Разнообразные белки осуществляют различные функции.
Практическое задание
Задание 1. Тест
1. Бесконечное разнообразие белков создается за счет различного сочетания аминокислот?
А – 20 Б – 46 В – около 80 Г – несколько тысяч
2. Неизменяемые части аминокислот
А – аминогруппа и карбоксильная группа Б – радикал
В – карбоксильная группа Г – радикал и карбоксильная группа
3. В строении белков различают
А – два уровня организации молекулы Б – три уровня организации молекулы
В – четыре уровня организации молекулы Г – денатурацию
4. Связи, которые удерживают первичную структуру молекулы белка, называются
А – водородными Б – пептидными В – гидрофобными Г – дисульфидными
5 . Для лечения тяжелых форм сахарного диабета больным необходимо вводить
А – гемоглобин Б – антитела В – инсулин Г – гликоген
6 . Денатурация – это
А – утрата белковой молекулой своей природной структуры
Б – утрата белковой молекулой своей первичной структуры
В – восстановление белковой молекулой своей природной структуры
Г – восстановление белковой молекулой своей первичной структуры
7. Выберите НЕВЕРНОЕ утверждение.
А – Простые белки называют протеины, а сложные – протеиды.
Б – Белки – это основной источник энергии в клетке.
В – Необратимую денатурацию можно наблюдать, поджаривая яичницу.
Г – Денатурация может быть обратимой, если не нарушена первичная структура белка.
8. Кислород крови транспортируется
А – коллагеном Б – гемоглобином В – фибриногеном Г – инсулином
9. Ренатурация – это
А – утрата белковой молекулой своей природной структуры
Б – утрата белковой молекулой своей первичной структуры
В – восстановление белковой молекулой своей природной структуры
Г – восстановление белковой молекулой своей первичной структуры

10. Выберите ВЕРНОЕ утверждение.
А – В состав сложных белков, помимо протеина, входит небелковая часть.
Б – Белки – это основной источник энергии в клетке.
В – Любая денатурация обратима.
Г – Первичная структура белковой молекулы может быть представлена глобулой или фибриллой.
Задание 2.
Назовите известные Вам белки, укажите их местонахождение? (5 и более)
· кератин – рога, шерсть
Практическое задание необходимо отправить на электронную почту mnp.25101952@mail. ru
Источник
Денатурация— разрушение пространственной структуры белка.



Она происходит при нагревании белков, под действием радиоактивного излучения, некоторых химических веществ (кислот, щелочей, солей тяжёлых металлов). При денатурации белки изменяют свои свойства и теряют биологическую активность, несмотря на то, что их первичная структура сохраняется.
Примером денатурации служит изменение яичного белка при нагревании.
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурациябелка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы (рис. 4).
Рис. 2. Денатурация и ренатурация белковой молекулы.
Деструкция– необратимый процесс нарушения первичной структуры
Разложение при нагревании
При сильном нагревании белки горят . При этом образуются вещества со своеобразным запахом жженых перьев. По запаху можно легко отличить шерстяные или шёлковые волокна от синтетических.
Цветные реакции
Присутствие белка в растворе можно обнаружить с помощью качественных реакций, в результате которых образуются окрашенные продукты.
Если к раствору белка добавить раствор щёлочи и несколько капель раствора соли меди(II), то появляется красно-фиолетовое окрашивание. Эта реакция называется биуретовой.
Другая цветная реакция на белки ксантопротеиновая. Для её проведения к раствору белка при нагревании надо добавить концентрированную азотную кислоту . Образуется желтый осадок. Если после охлаждения в пробирку прилить раствор щёлочи или концентрированный раствор аммиака, то появится оранжевое окрашивание.
Таким образом,все белки – биополимеры, мономерами которых являются остатки аминокислот, соединенных пептидной связью. Различают четыре уровня пространственной организации белков: первичную, вторичную, третичную и четвертичную. Белки способны к денатурации и ренатурации (изменению и восстановлению своих высших структур), деструкции (необратимому нарушению первичной структуры). Разнообразные белки осуществляют различные функции.
Практическое задание
Задание 1. Тест
1. Бесконечное разнообразие белков создается за счет различного сочетания аминокислот?
А – 20 Б – 46 В – около 80 Г – несколько тысяч
2. Неизменяемые части аминокислот
А – аминогруппа и карбоксильная группа Б – радикал
В – карбоксильная группа Г – радикал и карбоксильная группа
3. В строении белков различают
А – два уровня организации молекулы Б – три уровня организации молекулы
В – четыре уровня организации молекулы Г – денатурацию
4. Связи, которые удерживают первичную структуру молекулы белка, называются
А – водородными Б – пептидными В – гидрофобными Г – дисульфидными
5 . Для лечения тяжелых форм сахарного диабета больным необходимо вводить
А – гемоглобин Б – антитела В – инсулин Г – гликоген
6 . Денатурация – это
А – утрата белковой молекулой своей природной структуры
Б – утрата белковой молекулой своей первичной структуры
В – восстановление белковой молекулой своей природной структуры
Г – восстановление белковой молекулой своей первичной структуры
7. Выберите НЕВЕРНОЕ утверждение.
А – Простые белки называют протеины, а сложные – протеиды.
Б – Белки – это основной источник энергии в клетке.
В – Необратимую денатурацию можно наблюдать, поджаривая яичницу.
Г – Денатурация может быть обратимой, если не нарушена первичная структура белка.
8. Кислород крови транспортируется
А – коллагеном Б – гемоглобином В – фибриногеном Г – инсулином
9. Ренатурация – это
А – утрата белковой молекулой своей природной структуры
Б – утрата белковой молекулой своей первичной структуры
В – восстановление белковой молекулой своей природной структуры
Г – восстановление белковой молекулой своей первичной структуры

10. Выберите ВЕРНОЕ утверждение.
А – В состав сложных белков, помимо протеина, входит небелковая часть.
Б – Белки – это основной источник энергии в клетке.
В – Любая денатурация обратима.
Г – Первичная структура белковой молекулы может быть представлена глобулой или фибриллой.
Задание 2.
Назовите известные Вам белки, укажите их местонахождение? (5 и более)
· кератин – рога, шерсть
Практическое задание необходимо отправить на электронную почту mnp.25101952@mail. ru
Источник
Видеоурок по биологии «Белки»
Белки — это строительные материалы и живые нано-машины нашего тела. По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ ) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется ( полимеризацией ). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем .
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Денатурация белка происходит и под действием растворов солей тяжёлых металлов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией .
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы . Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура . Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка . Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата .
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Источник