Денатурация белков
Денатурация белков (от лат. de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы.
Содержание
Механизмы денатурации
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Ренатурация
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима.
См. также
Ссылки
Wikimedia Foundation . 2010 .
Смотреть что такое «Денатурация белков» в других словарях:
денатурация белков — – явление разрушения нативной (вторичной, третичной и четвертичной) структуры белка под действием химических и физико химических факторов … Краткий словарь биохимических терминов
Денатурация белков — * дэнатурацыя бялкоў * denaturation of proteins разворачивание белковой молекулы, потеря ею четвертичной, третичной и вторичной структур под действием высокой температуры или ионных детергентов, таких как содиумдодецил сульфат. Переход из… … Генетика. Энциклопедический словарь
денатурация белков — (иск. лат. denaturare лишать природных свойств) изменение естественных свойств белков при изменении физ. и хим. условий среды (температуры, давления и т. п.), проявляющееся в понижении растворимости белков, повышении вязкости их растворов,… … Словарь иностранных слов русского языка
ДЕНАТУРАЦИЯ БЕЛКОВ — потеря, изменение естественных свойств белков (растворимости, гидрофильности, вязкости и т. д.) вследствие нарушения естественной вторичной и третичной структур под влиянием высокой температуры, действия сильных кислот и щелочей, тяжелых металлов … Словарь ботанических терминов
Денатурация — Денатурация лишение естественных свойств Денатурация биополимеров изменение структуры их молекул, приводящее к потере их естественных свойств: Денатурация белков Денатурация нуклеиновых кислот Денатурация продуктов изменение… … Википедия
денатурация — и, ж. dénaturation f. 1. Изменение природной структуры молекулы белка, нуклеиновой кислоты и других биополимеров при воздействии физических и химических свойств среды (температуры, давления и т. п.). БАС 2. Белки природных продуктов называют… … Исторический словарь галлицизмов русского языка
ДЕНАТУРАЦИЯ — (от лат. De приставка, означающая удаление, утрату, и nаtura природные свойства), утрата природной (нативной) конфигурации молекулами белков, нуклеиновых к т и др. биополимеров в результате нагревания, химич. обработки и т. п. Обусловлена… … Биологический энциклопедический словарь
денатурация — и, мн. нет, ж. ( … Словарь иностранных слов русского языка
Денатурация — белков (от Де. и лат. natura природные свойства, сущность), характерное для белковых веществ изменение их строения и естественных свойств при изменении физических и химических условий среды: при повышении температуры, изменении… … Большая советская энциклопедия
денатурация — см. денатурировать; и; ж. Денатура/ция белков. Денатура/ция спирта … Словарь многих выражений
Источник
Уровни организации белковой молекулы



Белки
В клетке содержится много органических соединений. К ним относят биологические полимеры – белки, нуклеиновые кислоты и углеводы, а также жиры и ряд небольших молекул – гормоны, пигменты, аминокислоты, простые углеводы, нуклеотиды и др. После удаления воды, в сухом остатке на 1 месте по содержанию стоят белки. Они составляют 10-20% от сырой массы и 50-80% от сухой массы клетки.
Белки называют также протеинами (греч. protos – первый, главный). Этим названием выделяется первостепенное значение белков для жизненного процесса.
Многие органические соединения, входящие в состав клетки, характеризуются большими размерами молекул. Как называются такие молекулы? (Макромолекулы). Они состоят обычно из повторяющихся сходных по строению низкомолекулярных соединений, связанных между собой ковалентными связями. Их строение можно сравнить с бусинками на нити. Как называются эти составные элементы? (Мономеры). Они образуют полимеры. Большинство полимеров построено из одинаковых мономеров.
Таким образом, белки –это высокомолекулярные полимерные соединения, мономерами которых являются аминокислоты.
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления белков пищи пищеварительными ферментами или собственных запасных белков. Природных аминокислот – 150, в белки входят – 20. 10 из них – незаменимые, т.е. они не способны синтезироваться в организме человека, но поступают в него с растительной пищей. И соответственно 10 – заменимые,образуемые в организме.
В организме человека встречается 5 млн типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Такое разнообразие обеспечивается сочетанием всего лишь 20 разных аминокислот, составляющих несколько сотен, а иногда и тысяч комбинаций. Теоретически из 20 аминокислот можно составить 2 * 10 18 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит формой, и свойствами.
Форма белковых молекул может быть спиралевидной, складчатой, шарообразной.
Таким образом, каждый белок имеет очень сложную структуру. Выделяют первичную, вторичную, третичную, четвертичную структуры.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка. Аминокислоты соединены между собой пептидными (ковалентными) связями.
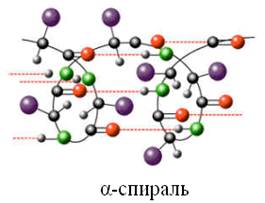
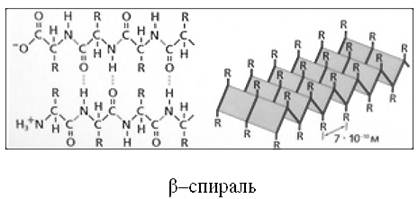
Вторичная структура – спираль с одинаковым расстоянием между витками (α-структура) или складчатый слой в виде «гармошки» (β-структура), образованная путем возникновения водородных связей.
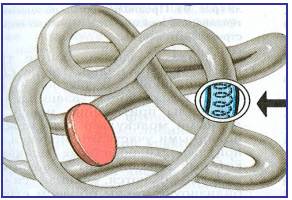
Третичная структура – клубок из полипептидной спирали. Третичная структурабелковой молекулы образуется благодаря взаимодействию радикалов, например радикалов аминокислоты цистеина, которые содержат серу. Таким образом, между радикалами двух аминокислот возникают так называемые дисульфидные (S – S) связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы.
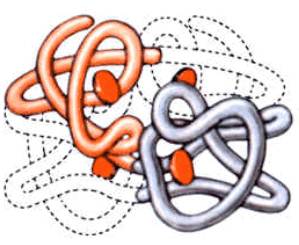
Четвертичная структура – структура из нескольких полипептидных цепей.
Пример такого сложного белка – гемоглобин.Его молекула состоит из четырех связанных между собой молекул, включающее также железо. Другой пример белка с четвертичной структурой – инсулин –гормон поджелудочной железы включает два компонента.
Процесс утраты белковой молекулой своей структурной организации называется денатурацией. Вначале разрушается самая слабая структура – четвертичная, затем третичная, вторичная и при более жестких условиях – первичная.
Денатурация белка может быть вызвана:
— изменение pH и др.
Процесс восстановления структурной организации белковой молекулы называется ренатурацией. Ренатурация наступает, если белок сохраняет первичную и вторичную структуры.
Источник
Процесс утраты белковой молекулой своей структурной организации
Ответы
1. Денатурация
2. Ренатурация
3. Нуклеотиды
4. Дезоксирибоза
5. Аденин, гуанин, цитозин, урацил А=У, Г(три черточки) Ц
6. 5 типов. Аденин, Тимин, гуанин, цитозин, урацил
7. взаимное соответствие в химическом строении двух макромолекул, обеспечивающее их взаимодействие спаривание двух нитей ДНК, соединение фермента с субстратом, антигена с антителом.
8. ..комплиментарности
Белки
В клетке содержится много органических соединений. К ним относят биологические полимеры – белки, нуклеиновые кислоты и углеводы, а также жиры и ряд небольших молекул – гормоны, пигменты, аминокислоты, простые углеводы, нуклеотиды и др. После удаления воды, в сухом остатке на 1 месте по содержанию стоят белки. Они составляют 10-20% от сырой массы и 50-80% от сухой массы клетки.
Белки называют также протеинами (греч. protos – первый, главный). Этим названием выделяется первостепенное значение белков для жизненного процесса.
Многие органические соединения, входящие в состав клетки, характеризуются большими размерами молекул. Как называются такие молекулы? (Макромолекулы). Они состоят обычно из повторяющихся сходных по строению низкомолекулярных соединений, связанных между собой ковалентными связями. Их строение можно сравнить с бусинками на нити. Как называются эти составные элементы? (Мономеры). Они образуют полимеры. Большинство полимеров построено из одинаковых мономеров.
Таким образом, белки –это высокомолекулярные полимерные соединения, мономерами которых являются аминокислоты.
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления белков пищи пищеварительными ферментами или собственных запасных белков. Природных аминокислот – 150, в белки входят – 20. 10 из них – незаменимые, т.е. они не способны синтезироваться в организме человека, но поступают в него с растительной пищей. И соответственно 10 – заменимые,образуемые в организме.
В организме человека встречается 5 млн типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Такое разнообразие обеспечивается сочетанием всего лишь 20 разных аминокислот, составляющих несколько сотен, а иногда и тысяч комбинаций. Теоретически из 20 аминокислот можно составить 2 * 10 18 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит формой, и свойствами.
Форма белковых молекул может быть спиралевидной, складчатой, шарообразной.
Таким образом, каждый белок имеет очень сложную структуру. Выделяют первичную, вторичную, третичную, четвертичную структуры.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка. Аминокислоты соединены между собой пептидными (ковалентными) связями.
Вторичная структура – спираль с одинаковым расстоянием между витками (α-структура) или складчатый слой в виде «гармошки» (β-структура), образованная путем возникновения водородных связей.
Третичная структура – клубок из полипептидной спирали. Третичная структурабелковой молекулы образуется благодаря взаимодействию радикалов, например радикалов аминокислоты цистеина, которые содержат серу. Таким образом, между радикалами двух аминокислот возникают так называемые дисульфидные (S – S) связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы.
Четвертичная структура – структура из нескольких полипептидных цепей.
Пример такого сложного белка – гемоглобин.Его молекула состоит из четырех связанных между собой молекул, включающее также железо. Другой пример белка с четвертичной структурой – инсулин –гормон поджелудочной железы включает два компонента.
Процесс утраты белковой молекулой своей структурной организации называется денатурацией. Вначале разрушается самая слабая структура – четвертичная, затем третичная, вторичная и при более жестких условиях – первичная.
Денатурация белка может быть вызвана:
– изменение pH и др.
Процесс восстановления структурной организации белковой молекулы называется ренатурацией. Ренатурация наступает, если белок сохраняет первичную и вторичную структуры.
Функции белков:
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома – страшная бессонница, которая потом кажется страшным сном. 8612 – 

91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
1. Денатурация
2. Ренатурация
3. Нуклеотиды
4. Дезоксирибоза
5. Аденин, гуанин, цитозин, урацил А=У, Г(три черточки) Ц
6. 5 типов. Аденин, Тимин, гуанин, цитозин, урацил
7. взаимное соответствие в химическом строении двух макромолекул, обеспечивающее их взаимодействие спаривание двух нитей ДНК, соединение фермента с субстратом, антигена с антителом.
8. ..комплиментарности
Если ответ по предмету Биология отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.
Источник