Биология в лицее
Сайт учителей биологии МБОУ Лицей № 2 г. Воронежа, РФ 







Site biology teachers lyceum № 2 Voronezh city, Russian Federation
Основные свойства и функции белков
Аминогруппа позволяет аминокислотам выступать в роли оснований и реагировать с кислотами.
Благодаря этому аминокислоты и белки служат буферами, т. е. противодействуют изменениям кислотности и щёлочности, защищая протоплазму клетки.
Для белковой молекулы характерны ещё два свойства: денатурация и ренатурация.
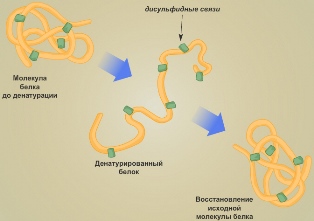
Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздаётся структура белка. Такой процесс носит название ренатурации.
Явление денатурации белка знакомо всем: каждый наблюдал, как прозрачное жидкое содержимое яйца после нагревания становится плотным и непрозрачным.
Свойство ренатурации широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например антибиотиков, для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Функции белков в клетке
| Функция | Пояснение |
|---|---|
| Каталитическая | Самый многообразный и наиболее специализированный класс белков — это ферменты . Они отвечают за работу точно и гибко согласованной системы взаимозависимых химических реакций, в результате совместного протекания которых возможна жизнь |
| Структурная | Белки участвуют в формировании клеточных и внеклеточных структур, например, входят в состав клеточных мембран ( липопротеиды и гликопротеиды ), волос ( кератин ), сухожилий ( коллаген ) и др. |
| Двигательная | Сократительные белки — актин и миозин — обеспечивают сокращение мышц у многоклеточных животных |
| Транспортная | В клеточных мембранах присутствуют особые транспортные белки, способные связывать некоторые вещества, например, глюкозу, аминокислоты и переносить их внутрь клеток. Гемоглобин транспортирует кислород и частично углекислый газ |
| Регуляторная | Некоторые гормоны имеют белковую природу. Например, инсулин , регулирующий уровень глюкозы в крови |
| Защитная | Иммуноглобулины (или антитела) обладают способностью распознавать проникшие в организм чужеродные белки или микроогранизмы и обезвреживать их. Фибриноген и протромбин участвуют в процессе свертывания крови и предохрняют организм от кровопотерь. Токсины также можно отнести к белкам, выполняющим защитную функцию |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. |
| Запасающая | Альбумин яиц и казеин молока — резервные белки животных |
| Сигнальная | В мембраны клеток встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды и передавать, таким образом, сигналы в клетку |
Белки-ферменты
Ферменты (лат. fermentum — закваска) — специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме, катализируются соответствующими ферментами.
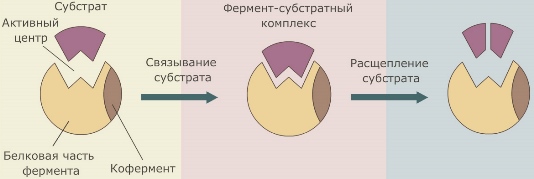
Вещество, на которое оказывает действие фермент, называется субстратом. Вещества, получающиеся в результате ферментативной реакции, называются продуктами реакции.
Направляя и регулируя обмен веществ, ферменты играют важнейшую роль во всех процессах жизнедеятельности.
Классификация ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя к названию субстрата суффикс -аза (например, лактаза — фермент, участвующий в превращении лактозы ). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФ-аза).
По типу катализируемых реакций ферменты подразделяются на 6 классов:
- Оксидоредуктазы катализируют окисление или восстановление (например, каталаза, алкогольдегидрогеназа).
- Трансферазы катализируют перенос химических групп с одной молекулы субстрата на другую (например, киназы, переносящие фосфатную группу с молекулы АТФ).
- Гидролазы катализируют гидролиз химических связей (к этому классу относится большинство пищеварительных ферментов, например, пепсин, трипсин, амилаза, липаза).
- Лиазы катализируют разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
- Изомеразы катализируют структурные или геометрические изменения в молекуле субстрата.
- Лигазы катализируют образование химических связей между субстратами за счет гидролиза АТФ (например, ДНК-полимераза).
Строение и механизм действия ферментов
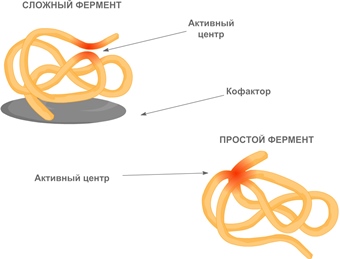
Кофакторы могут быть как неорганическими молекулами (например, ионы металлов), так и органическими (например, гем гемоглобина). Кофакторы органической природы, способные отделяться от фермента, называют еще коферментами. Роль коферментов часто играют витамины.
В молекуле фермента выделяют особую часть — активный центр. Это небольшой участок молекулы (от 3 до 12 аминокислотных остатков), где происходит связывание субстрата (или субстратов) и образуется фермент-субстратный комплекс.
Свойства реакций ферментативного катализа
1. Строгая специфичность. Ферменты проявляют строгую специфичность, то есть один фермент катализирует только одну реакцию.
2. Высокая скорость. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз выше скорости реакций, идущих с участием неорганических катализаторов.
Факторы, влияющие на скорость ферментативных реакций
Скорость ферментативных реакций зависит от ряда факторов.
1. Температура. Большинство ферментов может работать при температуре от 0 о С до 40 о С. При более низкой температуре ферменты неактивны, при более высокой подвергаются денатурации. Поскольку белки в сухом состоянии денатурируют значительно медленнее, чем белки в растворенном виде, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до более высоких температур, чем те же споры или семена в увлажненном состоянии.
2. Концентрация субстрата. При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции пропорциональна концентрации фермента. Скорость реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При этом происходит насыщение всех активных центров молекул фермента.
3. Концентрация фермента. Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
4. рН. Для каждого фермента существует оптимальное значение рН, при котором проявляется максимальная каталитическая активность (например, для пепсина оптимум рН=2,0, а для липазы поджелудочной железы рН=9,0).
5. Активаторы и ингибиторы. Скорость работы некоторых ферментов регулируется особыми веществами — активаторами (ускоряют реакцию) и ингибиторами (замедляют реакцию). Эти вещества способны присоединяться к молекулам фермента и либо облегчать связывание активного центра молекулы фермента с субстратом, либо делать невозможным образование фермент-субстратного комплекса.
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность. Существует два типа модификации: присоединение химических групп к боковым остаткам полипептидной цепи и расщепление полипептидной цепи.
Источник
Что такое утрата белковой молекулой своей структурной организации
Денатурация белка
Что такое денатурация белка?
Утрата белковой молекулой своей структурной организации называется денатурацией. Денатурация может быть обратима, если не разрушена первичная структура белка. В этом случае при восстановлении нормальных условий (температуры, кислотности и др.) происходит ренатурация.
Функции белков
Какие функции белков вам известны?
1. Каталитическая. Все биологические катализаторы — ферменты — имеют белковую природу.
2. Пластическая (строительная). Белки входят в состав клеточной мембраны и образуют немембранные структуры клетки (например, цитоскелет) и часть межклеточного вещества.
3. Транспортная. Например, гемоглобин переносит кислород в крови, в мембранах клеток имеются специальные транспортные белки, активно переносящие определенные вещества в клетку.
4. Регуляторная. Некоторые гормоны имеют белковую природу — инсулин, гормоны гипофиза.
5. Сигнальная. На наружной поверхности клеточной мембраны имеется множество специфических рецепторов гликопротеидной природы, воспринимающих внешние воздействия (гормоны) или определяющих характер взаимодействия клетки с вирусом.
6. Двигательная. Все виды движения обеспечиваются специфическими сократительными белками (актин, миозин; белки микротрубочек веретена деления).
7. Защитная. В ответ на внедрение инородных веществ (антигенов) клетками крови (лейкоцитами) синтезируются специальные белки — антитела.
8. Энергетическая. При расщеплении 1 г белка выделяется 17,6 кДж энергии (4,2 ккал).
Углеводы
Какие химические соединения называют углеводами?
Углеводы — органические соединения с общей формулой Cn(H2O)m.
Содержание углеводов в клетках
Какие клетки наиболее богаты углеводами?
Наиболее богаты углеводами растительные клетки, где их содержание иногда достигает 90% сухой массы (клетки клубней картофеля, семена). В животных клетках содержание углеводов не превышает 2–5%.
Моносахариды
Что такое моносахариды? Приведите примеры.
Простые углеводы называют моносахаридами. В зависимости от количества атомов углерода в молекуле их называют триозами — 3 атома, тетрозами — 4 атома, пентозами — 5 атомов и гексозами — 6 атомов углерода в молекуле.
Из шестиуглеродных моносахаридов наиболее важны глюкоза, фруктоза и галактоза, принимающие активное участие в процессах метаболизма. Из пятиуглеродных моносахаридов — дезоксирибоза и рибоза, входящие в состав соответственно ДНК и РНК.
Дисахариды
Что такое дисахариды? Приведите примеры.
Дисахаридами называют химические соединения, образованные двумя молекулами моносахаридов. Например, пищевой сахар — сахароза состоит из одной молекулы глюкозы и одной молекулы фруктозы.
Мономер крахмала, гликогена, целлюлозы
Какой простой углевод служит мономером крахмала, гликогена, целлюлозы?
Мономером данных полисахаридов служит глюкоза. При этом крахмал и гликоген представляют собой разветвленные полимеры, а целлюлоза — линейный.
Функции углеводов
Укажите функции углеводов.
1. Энергетическая. Глюкоза — основной источник энергии в организме. При сгорании 1 г глюкозы образуется 17,6 кДж (4,2 ккал) энергии.
2. Сигнальная. Углеводы входят в состав гликопротеидных рецепторов, расширенных на поверхности клеточной мембраны.
3. Резервная. Углеводы обеспечивают запас питательных веществ в клетке в виде зерен крахмала или глыбок гликогена.
4. Пластическая. Углеводы образуют клеточную стенку растений (целлюлоза), грибов (хитин); формируют наружный хитиновый скелет членистоногих.
Что такое жиры? Опишите их химический состав.
Жиры — это эфиры высокомолекулярных жирных кислот и трехатомного спирта глицерина. Характерной особенностью жиров является их гидрофобность — нерастворимость в воде.
Функции жиров
Какие функции выполняют жиры?
1. Пластическая. Фосфолипиды образуют клеточные мембраны.
2. Энергетическая. При окислении 1 г жиров выделяется 38,9 кДж (9,3 ккал) энергии.
3. Жиры являются растворителями для гидрофобных веществ, например витаминов (A, D, Е).
4. Резервная. Жировые включения — капли жира в цитоплазме клетки.
5. Терморегуляция. За счет плохой теплопроводности жировая ткань может служить теплоизолятором.
6. Защитная. Рыхлая жировая ткань при механическом повреждении предохраняет подлежащие органы от травмы.
Источник